Mayer Brezis, Failing Public Health Again? Analytical Review of Depression and Suicidality From Finasteride,The Journal of Clinical Psychiatry (2025). 精神科の雑誌
DOI: 10.4088/jcp.25nr15862 を日本語訳し、一般的に有用な内容のみにしています。 ■ と ■の間に作者コメントを入れています。
■の間にサイト製作者のコメントを記載しています■ リンク先の論文を日本語訳化しています。一般の方が分かりにくい文章はカットしています。
もくじ
初めに
背景:男性型脱毛症(AGA)に広く処方されているフィナステリドは、服用中止後もうつ病、不安、自殺念慮などの重篤な神経精神症状を引き起こす可能性が長らく疑われてきました。
■以前から指摘されていますが、会社的にはおそらく不利益なことなので追及していない、もしくはわかっているが発表しない方向なのだと感じます
■美容関連の薬なので追及が厳しくないのかもしれません■
観察:フィナステリドによるうつ病への懸念は、2002年という早い時期に複数の研究で提起されました。2017年から2023年にかけて、有害事象報告システムに関する4件の独立した分析と、医療記録のデータマイニングを用いた4件の研究において、フィナステリドの使用により、うつ病、不安、および/または自殺行動のリスクが有意に増加することが示されました。■不安:パニック障害もふくまれると考えた方がよいと感じます■
潜在的な危害と影響:世界中で20年以上にわたり、数十万人がうつ病に苦しみ、数百人が自殺した可能性があります。予防原則によれば、美容医薬品によるこのようなリスクは、介入(■薬を使用する事■)が有害ではないことを証明する責任は製造業者にあります。■論文はフィナステリドの製薬会社の考え方に責任があると考えています。■
リスク認識の遅れの原因:フィナステリド曝露に関連するリスクの認識が長期間遅れた理由としては、製造業者がデータベース分析を使用した簡単な薬物安全性調査を実施および公表しなかったこと、規制当局が製造業者にそのような調査を要求しなかった、または調査を実施しなかったことなどが挙げられます。■製薬会社としては利益の上がっている薬剤なので国の管理者から指導がなければあえて会社に不利益な行動は起こさないのは当然かもしれません■
結論と関連性:最新のエビデンスは、フィナステリドの使用がうつ病や自殺傾向を引き起こす可能性があることを示している。過去の文献レビューは、研究エビデンスと規制措置の間にギャップがあることを明らかにしている。この教訓は、医薬品を市場に承認する前に、規制当局は製造業者に対し、承認後の継続的な分析研究の実施と情報開示を義務付けるべきであり、この要件は確実に実施される必要があるということである。■管理者側の努力不足を指摘しています。■
臨床精神医学ジャーナル2025;86(4):25nr15862
この論文は、数年前に「ただ」髪質改善のためだけにフィナステリドを服用し始めた健康な人の思い出に捧げられています。彼は1週間以内に重度の神経精神症状を発症し、服用を中止しても症状は改善しませんでした。最高の専門医による治療も効果がなく、数か月後、彼は自殺しました。
テストステロン変換を阻害する5α還元酵素阻害剤であるフィナステリドは、1997年に米国食品医薬品局(FDA)により男性型脱毛症(AGA)の治療薬として承認されました。FDAは、2011年にうつ病をはじめとする精神的な副作用を認識し、2022年には自殺傾向も認めました。欧州医薬品庁(EMA)は2025年にフィナステリドが自殺を引き起こす可能性があることを認めました。しかし、この段階では、フィナステリド使用者の一部にとっては手遅れだった可能性があります。
フィナステリドの使用によるうつ病および自殺のリスクを示唆する最新の証拠
表1は、過去10年間における神経精神医学的反応とフィナステリド曝露との潜在的な関連性を検証した研究をまとめたものです。主にAGA(男性型更年期障害)に処方された場合、すべての報告において、フィナステリドはうつ病、不安、自殺念慮、そして自殺を引き起こす可能性があることが示唆されています。帰無仮説(フィナステリドは気分に影響を与えない)を仮定し、この仮説に反する結果が1件出る確率が50%であるとすると、8つの研究すべてが偶然に帰無仮説に反する結論に至る確率は0.5です。= 0.0039。■統計学的にかなり有意差がある数字でつまりかなりの確率でうつ病、不安、自殺念慮、そして自殺を引き起こす、ということです■
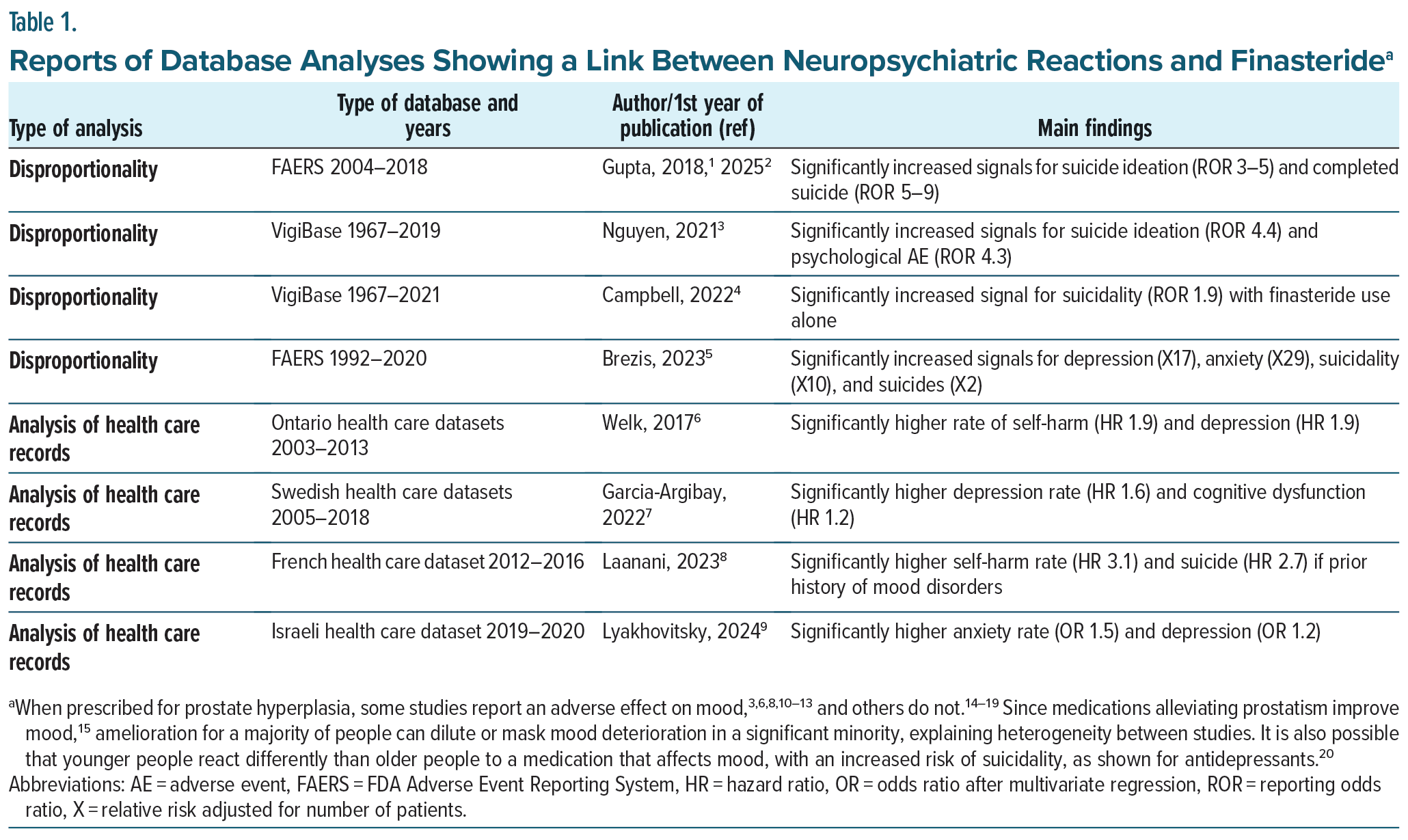
表1にまとめられているように、分析により、フィナステリドは、これまでいくつかの症例シリーズで示されてきた重篤な気分障害を引き起こす可能性があることが確認されています。
フィナステリドの神経精神医学的影響に関する生物学的妥当性
動物および人間を対象とした研究では、フィナステリドが 5α 還元酵素を阻害することで、気分を調節する脳ホルモンである神経ステロイドの合成を低下させることが示されています。
神経ステロイドレベル、特にアロプレグナノロンの減少は、うつ病、不安、認知機能障害など、フィナステリドの使用に関連する神経精神医学的副作用に寄与すると考えられています。
神経精神医学的反応は、投薬中止後も長期間持続することが多く、自殺に至るほど重篤な場合もあります。海馬の神経新生、神経炎症、および遺伝子変化が、フィナステリドの長期的影響を媒介している可能性があります。
そのため、実験的研究および疫学的研究により、フィナステリドは、薬の使用を中止した後でも、うつ病、不安、自殺傾向などの重篤な神経精神医学的反応を引き起こす可能性があることが示されており、因果関係の証拠は強力であると思われます。
潜在的な危害と影響
フィナステリドによるうつ病への懸念は、2002年という早い時期に発表された複数の研究で提起されました。そのため、世界中で20年以上にわたり、多くの人がうつ病や自殺に苦しんでいた可能性があります。■このような指摘は多くありましたが、あまり実際的な変革はなされていません■
うつ病リスクの相対的増加は57%(報告書の推定値の平均)です。
6,7,9うつ病は自殺を強く予測するため、うつ病は自殺リスクを数倍に高める可能性があります。
32,33人口におけるうつ病および自殺傾向のベースラインの有病率から推定すると(上記、表 2 を参照)、20 年間にわたり世界中で 400 万人がフィナステリドに曝露された場合、数十万人が自殺傾向を伴ううつ病に至る気分の変化に耐え、数百人から数千人が自殺で死亡した可能性がある。

これらの数値は推測に基づくものではありますが、潜在的に重大な公衆衛生上の危険を示唆しています。予防原則によれば、34,35化粧品医薬品によるこのようなリスクは、利益と害のバランスが不利であることを示唆しており、公衆を保護するための措置を正当化するものであり、介入が有害ではないことを証明する責任は製造業者に課せられる。35 ■製薬会社が副作用に問題がない、と証明する必要がります■
歴史的視点
2002年にはすでに、AGAに対するフィナステリド治療中に19人の患者がうつ病を発症したと報告されています。36投薬中止後、2名は回復し、2名は再試験に同意しました。その結果、うつ病の再発が認められました。2006年には、128名の患者を対象とした前向き研究で、うつ病スコアの有意な上昇が示され、うつ病リスクの高い患者にはフィナステリドを慎重に処方すべきであると結論付けられました。
37この時点で、実験的研究により、神経活性ステロイドが気分調節に重要な役割を果たしていることがすでに示されており、その代謝はフィナステリドによって変化します。
38この安全性の問題はその後 FDA によって検討されました。
うつ病と自殺の報告不足
2010年、FDAはフィナステリドの副作用としてうつ病を含めることを検討したが、自殺念慮、自殺未遂、自殺既遂の報告数が予想よりも少ないことにも言及した。
39メルク社はフィナステリド使用者の数を秘密にしていたため、報告不足の実際の程度は明らかではありませんでした。FDA の文書では多くの部分が検閲されていました。たとえば、図 1では、テキストのセクション全体が大きな灰色の隠蔽によって覆われています。■すべてを公表すると不利益その他があるために、塗りつぶしていると考えられます。とても怪しい感じがします■

医薬品安全性レビューにおいて、どのようなデータが隠蔽されるのか想像しがたい。この時点で既に、世界中で約460万人の患者がフィナステリドを服用していたことは分かっている。■データが隠されている可能性が高い■
一般人口における自殺の発生率と自殺念慮の蔓延状況の報告に基づくと、この規模の一般集団がフィナステリド治療を受けた場合の予測数が計算され、表 2に示されている。
右側の列は、FDA 有害事象報告システム (FAERS) に報告された、フィナステリドの使用に関連する可能性のある実際の数を示している。
2011 年までに報告された自殺はわずか 18 件であったが、460 万人の集団における 10 年から 20 年の観察期間中に 6,440 ~ 12,880 件の自殺が予測された (この数字は過小評価であり、表 2の脚注を参照)。
2024 年までに合計 320 件の自殺が報告されたが、30 年間の観察期間中に 19,320 件の自殺が予測された。自殺念慮については、予測数が 414,000 件であったが、2011 年と 2024 年に報告されたのはそれぞれ 31 件と 1,062 件であった。■予想数より大幅に少ない理由を以下に記載■
この大幅な過少報告には複数の原因が考えられます。例えば、
自殺が成立した後は患者が報告できないこと、
家族が患者がフィナステリドを使用したことを知らない可能性があること、
家族と医師がフィナステリドへの曝露と自殺の潜在的な関連性に気づいていない可能性があることなど
同様に、自殺念慮についても、患者と医師がフィナステリドの使用との潜在的な関連性に気づいていない可能性があります。
過少報告への認識は、医薬品安全性監視において、個々の報告を受動的に収集し個別に分析するというアプローチを超えた、異なるアプローチを必要としました。
このアプローチでは、製薬会社は、結果とフィナステリド曝露との因果関係は立証できない、可能性は低い、あるいは罹患前状態による可能性が高いと主張し続けました。■言い訳を結構していた、という事です■
フィナステリドによる自殺リスクの判定になぜ長い時間がかかるのか?
臨床試験は有効性を判断するために設計されており、安全性をテストするには不十分です。特に、医薬品の承認が迅速化され、市販後調査では新たなツールの開発が必要となり、不均衡分析など医療記録におけるデータマイニング。これらのツールは、例えば減量薬による自殺傾向を評価するためにすぐに応用されました。フィナステリドによる自殺リスクの判定になぜ長い時間がかかったのでしょうか? 当初の報告でフィナステリドによるうつ病が示唆されてから10年以上も経過した現在、なぜ市販後調査のための新しいツール(表1に示す研究)が適用されたのでしょうか?この遅れにより、2019年当時、フィナステリド後症候群は、メディア報道に関連した妄想に苦しむ患者に対するノセボ効果と考えられていた。有害事象の報告は通常人為的に促されるものではないが、ノセボ効果による自殺は報告されていない。フィナステリドの場合、気分への影響の可能性に対する認識が高まったことで、実際の問題が明らかになったようです。
グプタらが最近報告したFAERSデータの不均衡分析では、フィナステリド服用者における自殺念慮の兆候は、2013年以降に初めて報告されました。これは、フィナステリドと精神疾患リスクの関連性の可能性を認識していなかった臨床医や患者による報告不足を反映している可能性があります(2011年以前にうつ病が初めて添付文書に記載されたため)。しかし、この発見と報告には10年を要しました。この兆候は2013年のFAERSデータに埋もれ、不均衡性分析によって発見されるまで待たされていました。それでも、この兆候は製造業者や規制当局から独立したグループによって2025年にようやく発見され、公表されました。つまり、製造業者と規制当局がそれを探すことを選択していたら、この兆候は10年前に検出されていた可能性があります。
前述の通り、2010年にFDAはフィナステリドの副作用としてうつ病の可能性を検討する一方で、自殺念慮、自殺未遂、そして自殺既遂の報告数が予想をはるかに下回る数値であったことも指摘しました。報告不足の認識から、15年後にグプタ氏らが行ったような医薬品安全性監視研究が求められました。FDAは不均衡性分析を要請できたはずであり、また要請すべきでしたが、実際にはそうしませんでした。製造業者は報告不足を認識していましたが、問題を軽視していました。
メーカーの沈黙
2011年以前にFDAがフィナステリドの副作用としてうつ病を取り上げていたにもかかわらず、表1に示されている研究はいずれもメルク社によって実施されたものでも、規制当局から要請されたものでもありませんでした。メルク社自身がこのツールの価値を科学的に検証し、2006年に次のような結論を出していたにもかかわらず、製造業者が有害事象報告システムに関する不均衡分析を実施しなかったことは注目に値します。■会社に不利なことはあえて行わない、という事■「従来の信号検出法の補助として使用できる十分な感度と特異性を示している」。メルク社が2013年以降、実践的な実世界の患者データベースの取得に数百万ドルを投資してきたことを考えると、健康保険記録のデータマイニングを実施していないことも驚きだ。これらの省略は、メルク社のウェブサイト上の主張「当社の医薬品で治療される患者の安全は最優先事項です」と矛盾している。そして、別のフィナステリド製造業者であるオルガノンは最近こう述べた。「オルガノンにとって、当社の医薬品とそれを使用する人々の安全性以上に重要なものは何もありません。」
研究は実施されたものの、公表されなかった可能性もある。もし実施されていたならば、表1の他の8つの研究と同様に、これらの研究でも懸念すべき兆候が検出された可能性が高い。また、メルク社は、自社の研究で示されたビオックスによる心筋梗塞のリスク増大を断固として否定しているため、これらの研究結果を否定する可能性がある。
研究の省略や隠蔽は、バイオックス大失敗後の訴訟の反動効果と関係があり、製品リスクの監視と研究に対するメーカーの意欲を削ぐものかもしれない。製薬業界の商業的利益と株主に対する忠誠心が、医薬品の安全性に関する懸念よりも優先されることがしばしば示されている。ビジネススクールの学者たちに与えられた典型的なロールプレイング演習では、致死的な毒性が疑われる医薬品に対する規制当局による禁止措置に彼らがしばしば抵抗することが示された。さらに、費用対効果の高い研究開発のために、業界では、特許期間が短い旧薬の監視研究よりも、革新的な薬が当然優先されます。
FDAの曖昧で問題のある立場
規制当局は市販後調査の課題への対応に苦慮している。FDAは2005年のガイダンスで示唆されていた通り、2010年にメルク社に対し、表1に示す分析試験の実施を要請すべきであった。おそらくFDAはそうしたのだが、この要請を公表しなかった。また、たとえ大規模なデータベースをもってしても、自殺の増加を検知することの難しさも指摘すべきだった。
検出力分析によれば、ベースラインの年間自殺発生率が2倍になったこと(α=.05、検出力80%で、0.00014から0.00028へ)を確立するには、追跡対象の人口が700万人以上である必要があり、10%の増加(0.00014から0.00015へ)を検知するには、10億人以上の人口が必要である。しかし、表2を見ると、このような自殺率の増加は、20年後には世界中でそれぞれ12,000人以上と1,200人以上の死者を意味する。これは、自殺を予測する指標としてのうつ病や希死念慮にもっと注意を払えば防げる高い犠牲である。FDAはこの課題にも失敗したようだ。
2017年、ポストフィナステリド症候群財団は、うつ病と自殺念慮のリスクを理由に、フィナステリドを市場から撤去するようFDAに請願書を提出しました。2022年、FDAは自殺念慮/自殺行為を副作用に含めることに同意するが、警告には含めないと回答しました。FDAが新たな研究を要請したり実施したりすることなく、この回答を出すのに5年もかかった理由は不明です。
約20年前、バイオックスの大失敗後の劇的な議会公聴会で、FDAのグラハム博士は、FDAは米国を新たな医薬品の安全性の危機から守る能力がないと警告した。同氏は、FDA 承認薬の有害作用に関する懸念すべき調査結果を報告したことで、上司から自身や医薬品安全局の他の人たちが頻繁に批判されていたと説明した。予算のますます多くの部分が業界から支払われているため、同庁の独立性は疑問視されている。
偏った意思決定の顕著な例として、FDAの委員会は、2005年に毒性が証明されたバイオックスをメルク社が市場に再投入することを許可する勧告に投票しました。このFDA委員会のメンバーの多くが製造業者と繋がりを持っていたことが判明しました。透明性の欠如は、FDAに対する国民の信頼を損ないます。
フィナステリド使用者の自殺に関する最近の裁判から、FDAの専門家は既に2010年に、「自殺念慮および自殺行動」をラベルに追加するよう勧告していたようです。FDAはこの勧告を却下しましたが、内部での議論や最終決定の根拠は明らかにされていませんでした。
FDA は製造業者に医薬品安全性監視を実施するよう指導しています。しかし、人員不足により、回転の速い新薬の取り扱いで過負荷が増大していることもあって、当局は厳格な期限と慎重な施行を伴うそのような研究を頻繁に要求していないようだ。*
患者の自律性と社会的コストの両方を考慮する
薬剤の安全性は有効性の観点から議論されるべきである。
フィナステリドはAGAの治療に有効であることが証明されているが、システマティックレビューによると、試験は小規模で短期的であり、企業によって実施されている。そのため、エビデンスの質は中程度で、出版バイアス(否定的な結果が出た場合は肯定的な結果が出た研究に比べて公にされにくい)である可能性が高い。■つまり悪い結果は公表されにくい■
最近の分析では、長期的な有用性に疑問を投げかけているが、多くの若者は外見のためにこの薬を好む。
多くの場合、医師の処方箋なしでインターネット経由で入手します。
インフォームド・コンセントは、患者が潜在的な重篤な副作用を認識しつつ、服用する権利を守るために提案されている。しかし、多くの医師自身がフィナステリドに対する神経精神医学的反応を認識していないため、真の同意決定は実現しそうにない。
これらの悪影響による社会的コストは非常に高い。
うつ病の平均的な治療費と生産性の損失は、患者 1 人あたり年間約 24,000 ドルです。
フィナステリド使用者のうつ病率が50%上昇すると、世界中で20万人がうつ病に苦しみます。
年間48億ドルの費用がかかる可能性があります。
新規性と限界
本稿は、過去10年間に発表されたフィナステリドの神経精神医学的安全性に関する市販後調査のシステマティックレビューです。うつ病と自殺傾向についてくわしく検証しています。
これはフィナステリドの市販後調査に関する初のシステマティックレビューです。
このレビューには重大な限界があります。
薬剤による害を評価することは困難で、安全性の試験には不十分です。
疫学者は薬剤による害を検出・評価するために観察研究を用いることをより推奨するようになっています。
薬剤疫学研究は市販後の薬物有害反応の検出に不可欠であるものの、いくつかの限界があります。
自殺行動の兆候の増加は、実際の安全性の問題を示唆していますが、定量化することはできません。
フィナステリドが原因と考えられる自殺者の数の推定は推測のものです。
医療記録の解析 (表 1 を参照) では、うつ病率の大幅上昇に伴って自殺率も上昇すると予想されています。
表1にまとめた研究は、主にAGA(男性型脱毛症)に処方されるフィナステリドの効果について検討したものです。脱毛による心理的苦痛が、フィナステリドに起因する神経精神医学的反応を引き起こす可能性はあるでしょうか?
AGAに関連する精神的健康への影響に関する最近のシステマティックレビューとメタアナリシスでは、うつ症状との関連は認められませんでした。
対照的に、表1に示す研究では、フィナステリド使用者においてうつ病および/または自殺行動の発生率の上昇が報告されています。ある研究では、気分障害の既往歴のある人において、フィナステリドは自殺行動のリスク増加と関連していました。
以前に精神機能障害を患っていた人の中には、フィナステリドの使用により重篤な神経精神医学的反応を起こしやすい人がいる可能性があります。
前立腺肥大症に対するフィナステリドの処方については、気分への悪影響を報告する研究もあれば、そうでない研究もあります。(■ばらつきがあり、かならずしも気分への悪影響は出ませんでした■)
しかしながら、AGA(男性型更年期障害)を明確に対象として処方された場合は相反する結果はなく気分への悪影響でした(■悪い影響のみだったという意味■)
結論として、AGA治療薬フィナステリドに対する重篤な神経精神医学的反応の認識が20年も遅れ、美容医薬品による重大な害が発生しました。
これは製造業者が簡素な市販後分析試験を実施・公表しなかったこと、また規制当局がそれらを要求しなかったことに起因しています。
材料と方法
過去5年間、フィナステリドの安全性に関するすべての臨床研究と医薬品安全性監視研究を収集。 Google ScholarとDimensions AIを用いて、平均して年に2回、繰り返し検索が行われた。
過去10年間に発表されたフィナステリドに関する市販後調査のみを対象とし、特にうつ病と自殺傾向に焦点を当てています。
Google を使用して、フィナステリドの安全性に関する FDA 文書、および医薬品安全性監視に関する Merck 社または Organon 社の出版物をインターネットで検索。
自殺発生率の上昇を検出するために必要なサンプルサイズの検出力分析は、オンライン計算機https://clincalc.com/stats/samplesize.aspxを使用して実行されました。
フィナステリド使用者の数については、2010 年以前のメルク社のデータを引用した出版物で示された 460 万人という数字を使用しました。 実際の数は、おそらくはるかに多いでしょう。
数日または数週間服用を試みた後に、性的な副作用や精神的な副作用(薬の服用を中止した後も持続するものもあります)などの理由で服用を中止する人もいます。
また、数年間服用した後に服用を中止する人もいます。
5年間の平均服薬遵守率が約50%であると仮定すると、460万人という服薬遵守者数を維持するには、10~20年間でフィナステリドに曝露された人の数は、その2~4倍に上る必要があります。
EMA「欧州医薬品庁(European Medicines Agency)」は2025年初頭に更新された安全性レビューにおいて、「フィナステリドの推定曝露量は約2億7000万人/年」と述べています。
多くの人がインターネットからフィナステリドを入手しているため、正確な数値を把握することは困難です。
臨床ポイント
■脱毛症治療に広く処方されている美容薬フィナステリドは、薬の使用を中止した後でもうつ病や自殺傾向を引き起こす可能性がある。
こうした神経精神医学的反応の規模と重大さが認識されるまでに 20 年の遅れがあり、数十万人がうつ病に苦しみ、多くが自殺した可能性があります■フィナステリドに関しては難しい点があるのは確かです。 医師でフィナステリドの件の発言をされている医師も多くおられます。 ただし、本当にこの論文で議論せれているような患者様はネットで情報を発信しているような元気な医師へは行かないと思います。行くというのは受診という意味です。当院にもいやだという患者様がおられます。 ある程度論文等を読まれている方です。 特に外科系の医師にはわからないタイプの患者様だと思います。いろいろな患者様がおられる、という事。そして少ない患者様に大きなマイナスがある場合には、フィナステリドを飲まないという選択肢は極めて重要な治療にもなります。
患者様によってはフィナステイドの使用はその方にとって人生の大きなマイナスとなりえる、という事実を認識した上でフィナステリドの処方をする必要があると思います。■
■薄毛治療薬として広く使用されているフィナステリドが、精神的な有害事象と一貫して関連するとの報告が新しく出されました。 雑誌は精神科の論文集です。 精神科からの提言です。■
ヘブライ大学メイヤー・ブレジス教授による最新のレビューでは、2017年から2023年にかけて発表された主要研究を分析し、フィナステリド使用者における抑うつ、不安、自殺念慮の頻度が有意に高かったのです。
エビデンスは米国FDAの副作用報告やスウェーデン、カナダ、イスラエルなどの医療データベースにまたがり、地域を超えた一貫性が示されています。
作用機序として、テストステロンからDHTへの変換阻害に伴い、神経ステロイドの生成が抑制され、気分調整機構に影響を与える可能性が指摘されています。
「ポスト・フィナステリド症候群」と呼ばれる長期持続症状の報告。
不眠や認知機能障害、自殺念慮がフィナステリド服薬中止後も続く例が存在します。■医師の認識が少ないのは、本当に困っている患者様は医師の元へはこれなくなっている、来ない、という状況だからです。 家族の状況を詳しく理解してない場合が多く、届出ができない状況と言えます■
■問題点はFDAが2022年にようやく自殺念慮の警告を追加したものの、ブラックボックス警告には至っていない点です。つまりものすごく重要な課題として認識していない、という事です。■
美容関連の薬剤のため、リスクが過小評価されてきた可能性があります。
美容目的での広告中止、市販後調査の強化、自殺例における薬歴調査の徹底が提言されています。
フィナステリドの処方は患者本人や、家族に精神症状のリスクを説明し、使用中の気分変化には細心の注意を払う必要があります。
■薄毛の改善と引き換えに重大な精神的副作用を生じるリスクがあることを頭にいれて、適応や継続可否を判断する必要があります。■


